Aufgaben zu RedOx-Reaktionen
Wie gut kennst du dich mit Reaktionen aus? Hier findest du Aufgaben zur RedOx-Reaktion.
- 1
Bestimme die Oxidationszahlen der folgenden Moleküle.
Bestimme die Oxidationszahl von Eisen in und .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmung von Oxidationszahlen
Bei Ionen, wie z.B. , entspricht die Oxidationszahl der Gesamtladung des Ions. Wir erhalten also eine Oxidationszahl von +2.
Sauerstoff hat die Oxidationszahl -2. Da die Summe der Oxidationszahlen innerhalb eines Moleküls dessen Gesamtladung (in unserem Fall ) entspricht, erhalten wir folgende Gleichung:
Die Oxidationszahl von Eisen in ist also +3.
Atome in ihrer elementaren Form haben immer die Oxidationszahl 0. Folglich hat elementares Eisen eine Oxidationszahl von 0.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
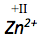
Das zweifach positiv geladene Zink-Ion erhält die Oxidationszahl +II.
Die Oxidationszahl eines Ions entspricht immer dessen Ladung.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
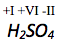
Die Oxidationszahl von Sauerstoff beträgt -II, von Wasserstoff -I. Die Summe der Oxidationszahlen des Moleküls muss 0 betragen, da es nicht geladen ist.
Die Oxidationszahl von Schwefel lässt sich wie folgt berechnen:
Die Oxidationszahl von Sauerstoff in einer Verbindung beträgt immer -II, die von Wasserstoff immer +I. Die Summe der Oxidationszahlen muss in einem Molekül immer dessen Ladung entsprechen.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmung von Oxidationszahlen
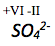
Die Oxidationszahl von Sauerstoff beträgt -II. Die Summe der Oxidationszahlen des Moleküls muss -2 betragen, da es zweifach negativ geladen ist.
Die Oxidationszahl von Schwefel lässt sich wie folgt berechnen:
Die Oxidationszahl von Schwefel lässt sich wie folgt berechnen:
Die Oxidationszahl von Sauerstoff in einer Verbindung beträgt immer -II. Die Summe der Oxidationszahlen muss in einem Molekül immer dessen Ladung entsprechen.
Bestimme die Oxidationszahl von .
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
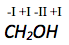
Die Oxidationszahl von Sauerstoff beträgt -II, von Wasserstoff -I. Die Summe der Oxidationszahlen des Moleküls muss 0 betragen, da es nicht geladen ist.
Die Oxidationszahl von Kohlenstof lässt sich wie folgt berechnen:
Die Oxidationszahl von Sauerstoff in einer Verbindung beträgt immer -II. Die Summe der Oxidationszahlen muss in einem Molekül immer dessen Ladung entsprechen.
- 2
Begründe ausführlich ob und wenn ja warum es sich bei folgenden Reaktionen um RedOx-Reaktionen handelt.
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
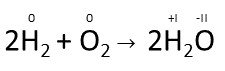
Bestimme zunächst alle Oxidationszahlen.
Die Oxidationszahlen der Atome ändern sich mit der Reaktion.
Bei der Oxidationsreaktion nimmt die Oxidationszahl zu, da Elektronen abgegeben werden.
Dei der Reduktionsreaktion nimmt die Oxidationszahl ab, da Elektronen aufgenommen werden.
Die Wasserstoffatome werden oxidiert, sie geben jeweils ein Elektron ab und ihre Oxidationszahl erhöht sich somit jeweils von 0 zu +I.
Die Sauerstoffatome werden reduziert, sie nehmen jeweils zwei Elektronen auf und ihre Oxidationszahl verringert sich von 0 zu -II.
Da sowohl eine Oxidations- als auch eine Reduktionsreaktion stattfindet handelt es sich hier um eine RedOx-Reaktion.
Bestimme zunächst alle Oxidationszahlen und überlege dir, was genau eine RedOx-Reaktion ausmacht.
Für diese Aufgabe benötigst Du folgendes Grundwissen: Bestimmen von Oxidationszahlen
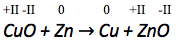
Bestimme zunächst alle Oxidationszahlen.
Die Oxidationszahlen der Atome ändern sich mit der Reaktion.
Bei der Oxidationsreaktion nimmt die Oxidationszahl zu, da Elektronen abgegeben werden.
Dei der Reduktionsreaktion nimmt die Oxidationszahl ab, da Elektronen aufgenommen werden.
Das Zinkatom wird oxidiert, es gibt zwei Elektronen ab und seine Oxidationszahl erhöht sich somit von 0 zu +II.
Das Kupferatom wird reduziert, es nimmt zwei Elektronen auf und seine Oxidationszahl verringert sich von +II zu 0.
Somit handelt es sich auch hierbei um eine Redoxreaktion.
Da sowohl eine Oxidations- als auch eine Reduktionsreaktion stattfindet handelt es sich hier um eine RedOx-Reaktion.
Bestimme zunächst alle Oxidationszahlen und überlege dir, was genau eine RedOx-Reaktion ausmacht.
- 3
Bestimme für die folgenden Redoxreaktionen jeweils die Teilgleichungen für Oxidation und Reduktion. Die Reaktionen laufen im basischen Milieu ab.
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen
Bestimmen der Oxidationszahlen.
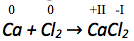
Betrachtung der Oxidationszahlen auf Edukt- und Produktseite der jeweils zusammengehörenden Atome.
Oxidation
Vergrößert sich die Oxidationszahl des Atoms so handelt es sich um die
Oxidation.
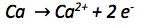
Die Oxidationszahl des Calciumatoms vergrößert sich von 0 auf +II. Es werden also abgegeben. Abgegebene Elektronen werden auf die rechte Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall sind die Ladungen bereits durch das -Ion ausgeglichen.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Ein Stoffausgleich ist hier nicht nötig.
Reduktion
Verkleinert sie sich, so handelt es sich um die Reduktion.
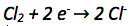
Die Oxidationszahl der Chloratome verkleinert sich von 0 auf -I. Es werden also aufgenommen. Aufgenommene Elektronen werden auf die linke Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall sind die Ladungen bereits durch die -Ionen ausgeglichen.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Ein Stoffausgleich ist hier nicht nötig.
Bestimme zunächst die Oxidationszahlen.
Überlege dir danach welche Teilreaktionen es gibt und bei welcher es sich um die Reduktion beziehungsweise Oxidation handelt.
Um die Teilgleichungen vollständig aufzustellen musst du folgende Schritte beachten.
Elektronen aufschreiben
Ladungsausgleich
Stoffausgleich
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen lösen
Bestimmen der Oxidationszahlen.
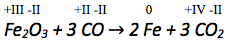
Betrachtung der Oxidationszahlen auf Edukt- und Produktseite der jeweils zusammengehörenden Atome.
Oxidation
Vergrößert sich die Oxidationszahl des Atoms so handelt es sich um die
Oxidation.
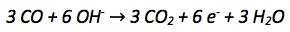
Die Oxidationszahl des Kohlenstoffatoms vergrößert sich von +II auf +IV. Es werden also abgegeben. Abgegebene Elektronen werden auf die rechte Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall müssen Sechs negative Ladungen der Elektronen ausgeglichen mithilfe von -Ionen werden.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Für den Stoffausgleich werden Wassermoleküle verwendet.
Reduktion
Verkleinert sie sich, so handelt es sich um die Reduktion.
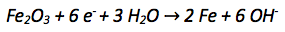
Die Oxidationszahl der Eisenatome verkleinert sich von +III auf 0. Es werden also aufgenommen. Aufgenommene Elektronen werden auf die linke Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall müssen 6 negative Ladungen der Elektronen durch -Ionen ausgeglichen werden.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Der Stoffausgleich findet mit Wassermolekülen statt.
Bestimme zunächst die Oxidationszahlen.
Überlege dir danach welche Teilreaktionen es gibt und bei welcher es sich um die Reduktion beziehungsweise Oxidation handelt.
Um die Teilgleichungen vollständig aufzustellen musst du folgende Schritte beachten.
Elektronen aufschreiben
Ladungsausgleich
Stoffausgleich
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen
Bestimmen der Oxidationszahlen.
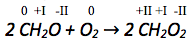
Betrachtung der Oxidationszahlen auf Edukt- und Produktseite der jeweils zusammengeh�örenden Atome.
Oxidation
Vergrößert sich die Oxidationszahl des Atoms so handelt es sich um die
Oxidation.
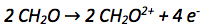
Die Oxidationszahl des Kohlenstoffatoms vergrößert sich von +II auf +IV. Es werden also pro Kohlenstoffatom abgegeben. Da es zwei Kohlenstoffatome gibt werden insgesamt abgegeben. Abgegebene Elektronen werden auf die rechte Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall muss nicht ausgeglichen werden.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Für den Stoffausgleich werden Wassermoleküle verwendet. Hier ist kein Stoffausgleich nötig.
Reduktion
Verkleinert sich die Oxidationszahl des Atoms so handelt es sich um die Reduktion.
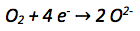
Die Oxidationszahl der Sauerstoffatome verkleinert sich von 0 auf -II. Es werden also pro Sauerstoffatom abgegeben. Da es zwei Sauerstoffatome gibt werden insgesamt abgegeben.. Aufgenommene Elektronen werden auf die linke Seite der Reaktionsgleichung geschrieben.
Der nächste Schritt ist der Ladungsausgleich, da auf beiden Seiten der Reaktionsgleichung die gleiche Anzahl an Ladungen vorkommen muss.
In diesem Fall ist die Gleichung bereits ausgeglichen.
Zuletzt muss überprüft werden ob ein Stoffausgleich nötig ist. Denn auf beiden Seiten der Reaktionsgleichung muss dieselbe Anzahl an Atomen stehen. Der Stoffausgleich findet mit Wassermolekülen statt. Hier ist kein Stoffausgleich nötig.
Bestimme zunächst die Oxidationszahlen.
Überlege dir danach welche Teilreaktionen es gibt und bei welcher es sich um die Reduktion beziehungsweise Oxidation handelt.
Um die Teilgleichungen vollständig aufzustellen musst du folgende Schritte beachten.
Elektronen aufschreiben
Ladungsausgleich
Stoffausgleich
- 4
Stelle zu folgender chemischen Reaktion zunächst die Reaktionsgleichung auf und arbeite daran die gelernte Schrittfolge zur Bestimmung der RedOx-Gesamtreaktion ab:
Permanganationen () reagieren im sauren Milieu mit Chloridionen zu elementarem Chlor und Mangan(II)-Ionen.
Für diese Aufgabe benötigst Du folgendes Grundwissen: RedOx-Reaktionen
1) Summengleichung aufstellen
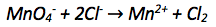
2) Bestimmen der Oxidationszahlen
Das Manganatom erhält die Oxidationszahl +VII, da das Manganation einfach negativ geladen ist, die Summe seiner Oxidationszahlen somit -I ergeben muss, und vier Sauerstoffatome enthalten sind, welche jeweils die Oxidationszahl -II besitzen.
Die Oxidationszahl des Chlor-Ions und des Mangan-Ions entspricht deren Ladung.
Elementares Chlor hat die Oxidationszahl 0.
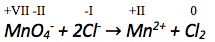
3) Zuordnung der Reaktionspärchen
Die Oxidationszahl des Manganatoms verringert sich, Mangan wird reduziert. Die der Chloratome erhöht sich, Chlor wird oxidiert.
4) Einzeichnen der übertragenen Elektronen
Jedes Chloratom gibt ein Elektron ab, somit erhöht sich die Oxidationszahl jeweils von -I auf 0.
Das Manganatom nimmt fünf Elektronen auf und verringert seine Oxidationszahl somit von +VII auf +II.
5) Ladungsausgleich
Im nächsten Schritt müssen die Ladungen in den Reaktionsgleichungen ausgeglichen werden. Diese Reaktion findet in saurem Milieu statt, das heißt es wird mit -Ionen ausgeglichen.
In der Oxidationsreaktion sind die Ladungen bereits ausgeglichen.
Hier müssen Ladungen ausgeglichen werden. Zähle dazu am besten wieviele Ladungen du auf jeder Seite hast und gleiche danach aus.
6) Stoffausgleich
Nun muss noch die Anzahl der Atome auf beiden Seiten der Gleichung ausgeglichen werden.
Hier muss nicht ausgeglichen werden.
7) Ausgleich der Elektronen
Zunächst vergleicht man die abgegebenen Elektronen bei der Oxidation mit den aufgenommenen bei der Reduktion. Dabei fällt auf, dass nur zwei Elektronen abgegeben werden, aber fünf aufgenommen werden. Damit die Anzahl übereinstimmt, musst man also die Oxidationsgleichung mit 5 multiplizieren und die Reduktionsgleichung mit 2.
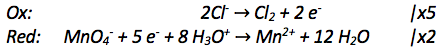
Nun stimmt die Elektronenanzahl bei Oxidation und Reduktion überein:
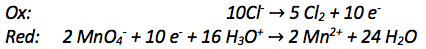
8) Aufstellen der Gesamtgleichung
Um die Gesamtgleichung aufzustellen müssen einfach beide Reaktionsgleichungen zusammengefasst werden.
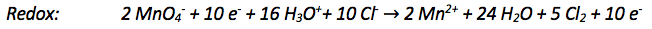
9) Kürzen der Gesamtgleichung
Nun kann alles gekürzt werden, was auf beiden Seiten der Gleichung vorkommt.
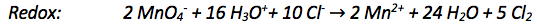
Hier nocheinmal das Lösungsschema für RedOx-Reaktionen:
Summengleichung aufstellen
Bestimmung der Oxidationszahl
Zuordnung der Reaktionspärchen
Einzeichnen der übertragenen Elektronen
Ladungsausgleich
Stoffausgleich
Ausgleich der Elektronen
Addition der Teilgleichungen
Kürzen der Gesamtgleichung
- 5
Welche Produkte entstehen bei der Verbennung von Methan?
Für diese Aufgabe benötigst Du folgendes Grundwissen: Verbrennung
Eine Verbrennung kann nur stattfinden wenn Sauerstoff vorhanden ist.
Das kann man übrigens ganz einfach testen. Stelle eine Kerze in ein Glas und zünde sie an. Decke das Glas nun ab. Du wirst sehen dass die Kerze ausgeht, sobald der Sauerstoff in der Luft verbraucht ist.
Die Edukte einer Verbrennung sind Kohlenstoffdioxid und Wasser.
Stelle die Reaktionsgleichung auf und überlege Dir, welche Edukte bei der Verbrennung nötig sind.